
安立璽榮醫藥預計 1 月 13 日登錄興櫃,創辦人暨董事長陳泓愷表示,目前有阿茲海默症、白斑症及癌症免疫三大新藥開發,其中阿茲海默新藥 EI-1071 預計今年完成 15 位二期臨床收案,至於白斑新藥 EI-001 預計明年上半年完成 45 位二期臨床收案。
陳泓愷表示,創業這段歷程從數十年前擔任神經內科實習醫生時的一個不尋常夢想,面對當時神經退化疾病患者只能接受「支持性治療」的無奈,下定決心尋找能真正解決問題的方法,因此安立璽榮的願景是運用團隊數十年在免疫領域的積累,開發出能真正改變患者生活的精準免疫新藥。
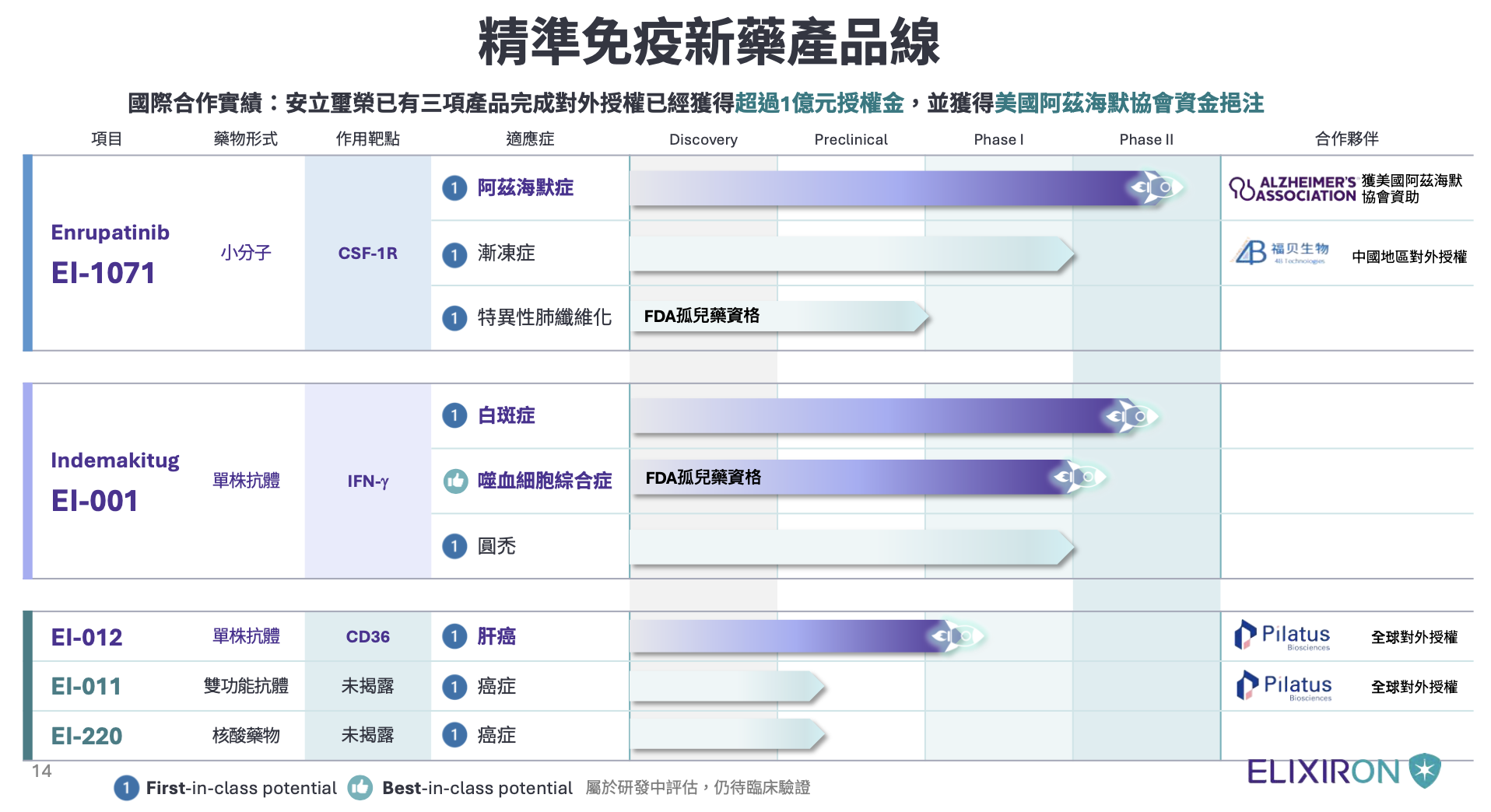
陳泓愷指出,安立璽榮旗艦產品 EI-1071,鎖定阿茲海默症的神經發炎,為安立璽榮最具代表性的產品之一,為治療阿茲海默症的小分子藥物,採取創新策略,靶向腦內微膠細胞的 CSF-1R 路徑,藉由抑制神經發炎來減緩失智退化。
陳泓愷分享,安立璽榮是亞洲唯一兩度獲得比爾蓋茲與美國阿茲海默症協會 Part the Cloud 聯合資助的新藥公司,獲得約新台幣 6,000 萬元的無償資金支持,並以此經費完成 EI-1071 美國一期臨床試驗,更在同類腦通透性 CSF-1R 抑制劑的競爭中,具備最佳腦通透性 97%、藥效且安全性。
臨床進度方面,陳泓愷指出,目前 EI-1071 已在台北榮總及三軍總醫院進行二期臨床試驗,預計將在今年完成 15 例收案,並取得初步臨床數據,計劃採用最先進的 TSPO PET/MRI 腦部發炎影像造影技術,以提高藥效評估的靈敏度。
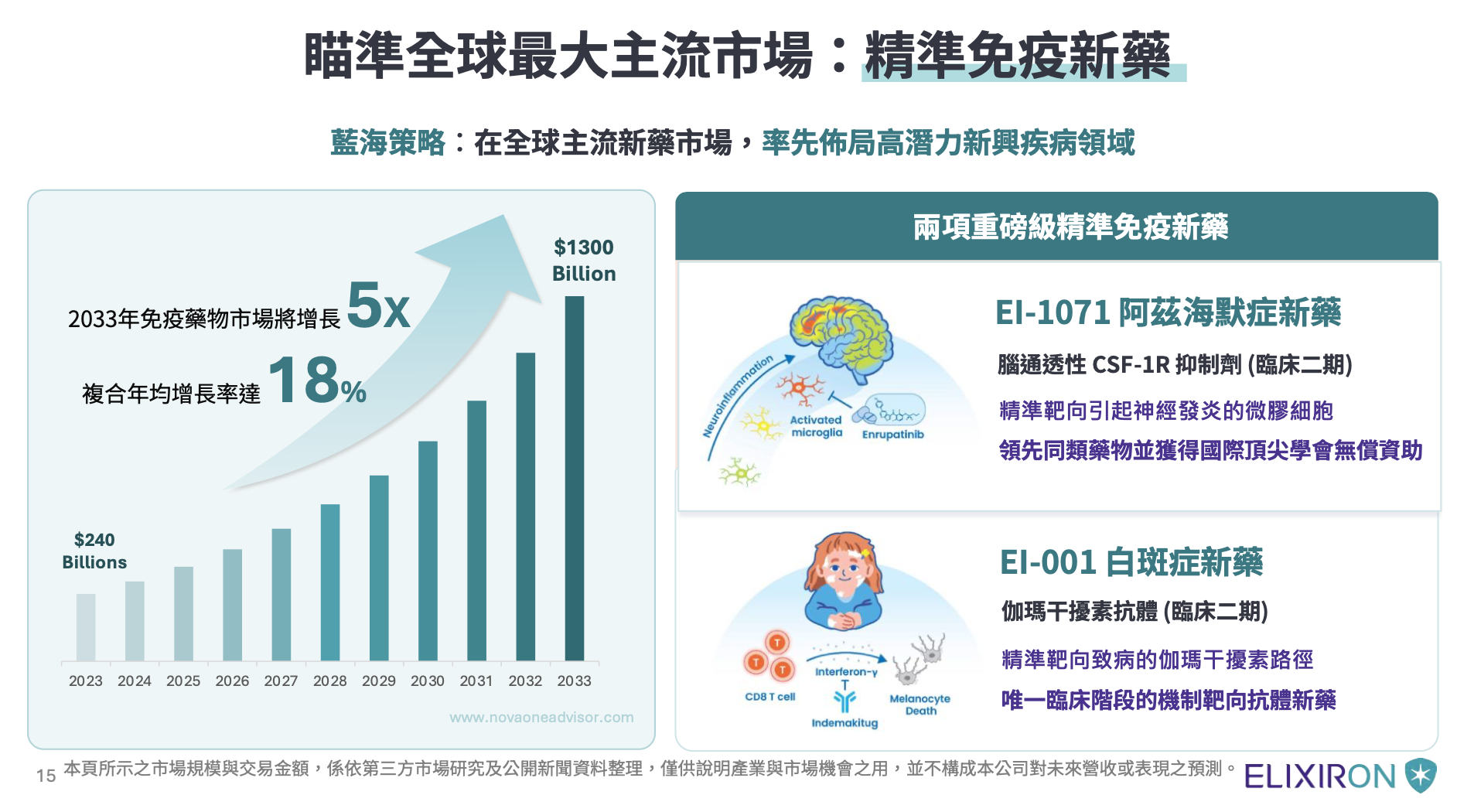
陳泓愷說明,安立璽榮第二項旗艦產品 EI-001,瞄準白斑症與罕見疾病的精準抗體,這是一種精準靶向伽瑪干擾素(IFN-γ)的全人源單株抗體,鎖定全球有超過 7,000 萬名白斑症患者,目前市面上缺乏高效且安全的主流藥物。
陳泓愷補充,EI-001 被定位為「精準導彈」,僅中和致病的伽瑪干擾素而不影響其他免疫路徑,並針對具高死亡率的罕見疾病噬血細胞綜合症(HLH)進行開發,已獲得美國 FDA 孤兒藥資格認定,其生物活性比現有上市藥物強約 13 倍,預計 2026 年啟動二期臨床,目標 2028 年申請藥品上市。
陳泓愷強調,安立璽榮-KY 採取「對外授權搭配特定區域自主開發」的雙軌模式,還有針對肝癌的 EI-012 抗 CD36 單株抗體已授權予美國合作夥伴,享有「授權金加股權增值」的雙重獲益,預計 2026 年在美展開一期臨床。
(首圖來源:科技新報)










